周末文摘 | 醫療器械唯一标識國内外進展
發布時間:2021-05-10
引用本文
易力,黃倫亮,餘新華*.醫療器械唯一标識國内外進展[J].中國食品藥品監管.2021.03(206):28-35.
醫療器械唯一标識國内外進展
Domestic and Global Progress of Unique Device Identification
易力
中國食品藥品檢定研究院
YI Li
National Institutes for Food and Drug Control
黃倫亮
國家藥品監督管理局
HUANG Lun-liang
National Medical Products Administration
餘新華*
中國食品藥品檢定研究院
YU Xin-hua
National Institutes for Food and Drug Control
Abstract
摘 要
Abstract
醫療器械唯一标識是當前全球醫療器械監管領域的熱點,本文概括了唯一标識的國際進展和國家相關宏觀政策,從我國唯一标識制度的建設和試點實施兩方面介紹了我國唯一标識進展, 為各方了解唯一标識相關知識,積極實施和應用唯一标識提供參考和借鑒。
Unique Device Identification (UDI) is a hot topic in the field of global medical device regulation. This article summarizes the progress of UDI on the global scale and national policies associated with UDI, and introduces development of the UDI system in China and the pilot program for UDI implementation. The authors hope to provide relevant information to stakeholders and promote implementation of the UDI system.
Key words
關 鍵 詞
Key words
醫療器械唯一标識;發碼機構;标準;數據庫
UDI; issuing agency; standard; database
2020 年10 月29 日, 黨的十九屆五中全會審議通過了《中共中央關于制定國民經濟和社會發展第十四個五年規劃和二〇三五年遠景目标的建議》(以下簡稱《建議》),《建議》提出:要加快發展現代化産業體系,推動經濟體系優化升級, 明确要提升産業鍊、供應鍊現代化水平,加快工業互聯網、大數據中心等新型基礎設施建設,推進數字産業化和産業數字化等。這些重大決策部署對醫療器械産業創新發展具有重要的指導意義,在“十四五”期間,醫療器械産業鍊、供應鍊數字化轉型升級将成為重要的戰略方向,作為重要基礎之一的醫療器械唯一标識(unique device identifier,UDI), 将成為串聯産業鍊、供應鍊、資金鍊、信用鍊的關鍵,逐漸引起各方的高度重視和認同并積極拓展基于UDI 的創新應用。2020 年9 月,國家藥監局、國家衛生健康委、國家醫保局聯合印發《關于深入推進試點做好第一批實施醫療器械唯一标識的公告》,标志着UDI的實施進入“三醫聯動”共同推進的新時代。
2020 年12 月國務院常務會議審議通過《醫療器械監督管理條例》,增設了UDI 條款,明确了國家根據醫療器械産品類别,分步實施醫療器械唯一标識制度,實現醫療器械可追溯,為我國推行UDI 制度奠定了法規基礎。
1 UDI 國際進展
UDI 是醫療器械全球監管的通用語言。國際醫療器械監管機構論壇(International Medical Device Regulators Forum,IMDRF) 于2013 年12 月發布《UDI 指南》,為全球實施UDI 提供了一個共認的技術框架建議,有助于各方無差别地識别特定的醫療器械,拉開了全球實施UDI的序幕[1]。2017 年加拿大渥太華舉辦的IMDRF 第12 次管理委員會會議,通過了《UDI 應用指南》新項目提案,重開UDI 工作組,來自10 個成員國監管機構代表和部分業界代表參與了文件的起草工作, 并于2019 年發布《UDI應用指南》以及兩份信息文件,分别為《在電子健康系統中記錄UDI》和《UDI 數據元素在不同IMDRF 成員國的使用》,共同指導2013 年《UDI 指南》的實施。
2007 年《FDA 修正案》和2012 年《FDA 安全和創新法案》分别确立了美國實施UDI 系統的立法依據和實施時間表,2013 年9 月美國FDA 發布《UDI 最終規則》,計劃通過7 年的時間分階段逐步實施UDI。目前美國Ⅱ、Ⅲ類産品已經全部實施UDI[2]。由于政策的複雜性和新冠肺炎疫情的影響,為了确保數據質量,美國FDA 先後兩次延遲了Ⅰ類産品的實施時間,根據目前最新的指南文件,2022 年9 月24 日前,美國FDA 不會要求I 類和未分類産品實施UDI[3]。
2017 年5 月,歐盟公報發布了醫療器械法規[REGULATION(EU)2017/745,簡稱“MDR”]和體外診斷試劑法規[REGULATION(EU)2017/746,簡稱“IVDR”],設置了UDI 專章,并規定了歐洲醫療器械數據庫(European database onmedical devices, Eudamed)的相關建設内容。歐盟委員會原計劃于2020 年5 月26 日對首批Ⅲ類醫療器械實施UDI,其他産品按照是否為IVD 産品和風險等級,分階段逐步實施UDI。受新冠肺炎疫情影響,歐盟将MDR的生效時間延後一年至2021 年5 月26 日,第一批産品的實施時間相應修改為新的MDR 生效時間[4]。對于Eudamed,目前已經開放角色注冊功能。
日本厚生勞動省自2002 年起,每年會對醫療器械等信息化進展情況進行調查,2008 年3月發布《關于對醫療器械等的條形碼顯示實施的通知》(醫政經發第0328001 号),主要目的是提高物流和醫保結算的效率。通知發布後3 年時間内按照風險等級逐步推進,并由醫療信息系統開發中心建立了數據庫,登記與醫療器械條形碼相關聯的信息。根據2012 年厚生勞動省針對部分企業調研情況,99.1% 的醫療器械企業注冊了GS1 條形碼,97.6% 的産品标記到了最小銷售單元,80% 的企業将數據上傳至數據庫[5]。日本以通知的形式提出了UDI 相關要求,主要是靠配送、銷售和醫保報銷結算等後方推動。據悉,日本當局目前正準備對UDI 系統開展立法。
除以上國家或地區外,越來越多的國家或地區,如沙特、印度、韓國等也陸續發布了UDI 相關法規,今後幾年将會是全球UDI 實施高峰期。
2 我國有關UDI 宏觀政策
通過建立醫療器械唯一标識系統(Unique Device Identification System,UDI 系統),有利于運用信息化手段實現對醫療器械在生産、經營和使用各環節的快速、準确識别;有利于實現産品監管數據的共享和整合;有利于創新監管模式,提升監管效能;有利于加強醫療器械全生命周期管理。以下就近年來我國有關政策中UDI系統建設和追溯體系建設兩方面分别介紹。
2.1 UDI 系統建設方面
早在2012 年,《國家藥品安全“十二五”規劃》提出啟動高風險醫療器械國家統一編碼工作,2017 年《“十三五”國家藥品安全規劃》明确提出制定醫療器械編碼規則,構建醫療器械編碼體系。2018、2019、2020 年深化醫藥衛生體制改革重點工作任務相關文件和2019 年《治理高值醫用耗材改革方案》中也均有UDI相關要求,随着UDI 制度的不斷推進,工作内容逐漸從制定法規到開展UDI 試點和實施,相關政策梳理見表1。

2.2 産品追溯方面
UDI 是醫療器械的“ 身份證”,其目的是醫療器械全生命周期的精準識别而非追溯,實現醫療器械的追溯需要相關方在各自的流程中使用和記錄UDI,屬于UDI 的應用層面。表2 梳理了近年來我國發布的關于産品追溯的相關文件,核心是通過信息化的手段,建立追溯體系,實現産品來源可查、去向可追、責任可究。2019 年《國務院關于加強和規範事中事後監管的指導意見》強調建立健全以産品編碼管理為手段的追溯體系,進一步明确了标識是實現追溯的重要手段(UDI 系統僅包括标識、載體和靜态數據庫三部分,本身不具備追溯的功能, 追溯是UDI 的應用場景)。

3 我國UDI 制度建設
我國UDI 制度建設采用“法規 - 标準 - 數據庫”三層體系,首先制訂《醫療器械唯一标識系統規則》(以下簡稱《規則》),指導各方開展UDI 相關工作;再分别從UDI、數據載體和數據庫方面制定标準、指南,開展編碼标準化工作;根據UDI 應用需求,逐步開展醫療器械編碼信息化建設。以下将從《規則》制定、相關标準制定、數據庫建設和發碼機構四個方面分别介紹。
3.1《 規則》制定
國家藥品監管部門高度重視UDI 工作, 早在2013 年, 委托原國家食品藥品監督管理總局醫療器械标準管理中心開展相關研究, 提出了我國以政府規範引導、企業主體實施的模式建立UDI 體系, 并于2014 年起草了《醫療器械編碼規則(草案)》。2017 年,原國家食品藥品監督管理總局召開UDI 工作會議,确定了醫療器械編碼體系建設的總體思路。為更好地與國際接軌,符合醫療器械唯一标識作為醫療器械身份标識的内涵,避免與分類編碼等稱謂混淆,清晰各方認識,統一理解,經反複研究論證,将《醫療器械編碼規則(征求意見稿)》修改為《醫療器械唯一标識系統規則(征求意見稿)》,分别于2018 年2 月和8 月在官網征求意見。2019 年8 月以國家藥監局公告的形式發布。《規則》共18 條,主要包括總則、UDI、UDI 數據載體、UDI 數據庫和附則5 部分[6]。
①總則部分明确了UDI 系統建設的目的、适用對象、适用範圍、建設原則、監管部門和相關方職責。
② UDI 部分明确了UDI 的制定原則和組成結構,以及唯一标識創建的主體和對發碼機構的要求。
③ UDI 數據載體部分規定了載體的形式、創建主體以及相關要求。
④ UDI 數據庫部分規定了數據庫責任主體和數據提交要求。
⑤附則部分包括相關術語的解釋、鼓勵各方應用以及實施時間的要求。
3.2 相關标準制定
根據國家藥監局工作部署,UDI 技術标準制定的要求主要包括:研究國際醫療器械編碼技術标準體系,充分考慮國際協調原則,結合我國行業編碼的基礎和現狀,制定發布醫療器械編碼基本要求和編碼術語等相關基礎通用标準。在已發布的信息化标準的基礎上,制定發布醫療器械編碼信息化系統數據收集、公開和交換規則和相關的接口等标準。目前國家藥監局已發布《醫療器械唯一标識基本要求》等4 項UDI 醫療器械行業标準(表3),為《規則》提供技術保障,确保《規則》初期的順利實施。
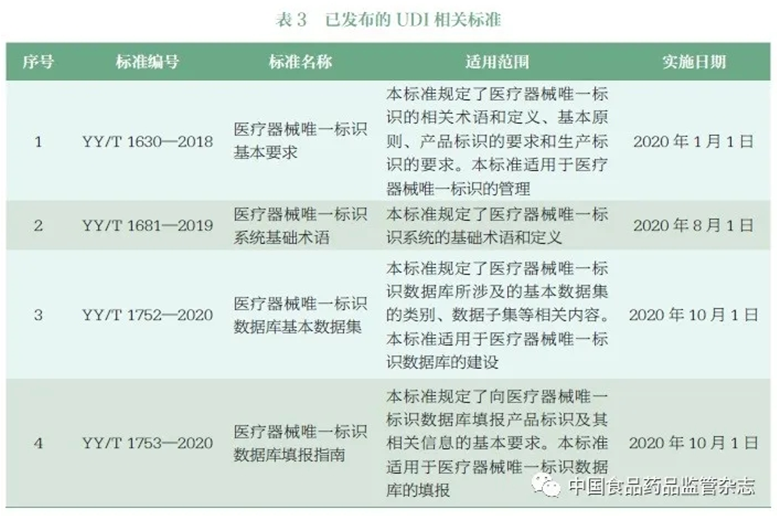
UDI 系統貫穿醫療器械注冊、生産流通、使用全生命周期,涵蓋标識、載體和數據庫,涉及發碼機構、信息技術機構和标準化機構等衆多技術支撐機構。UDI系統标準體系跨行業、跨領域的内容多,建設難度大。例如,發碼機構的标準是對醫療器械注冊人/ 備案人實施UDI 系統的具體要求,也是我國UDI 系統标準體系的有機組成;UDI 載體标準已在各行各業被廣泛使用和驗證,并非僅局限于醫療器械行業。我國UDI 系統标準體系應當多方參與,發揮各方的特長優勢,創建共赢的局面,同時也需要加強引導,規範行業行為。
3.3 UDI 數據庫
UDI 數據庫儲存醫療器械的産品标識與相關信息,是UDI 制度的具體實施落地。2019 年12月,國家藥監局醫療器械唯一标識數據庫上線運行,向試點企業開放産品标識及相關數據申報功能。2020 年3 月31 日開放數據庫共享功能,以查詢、下載、接口對接等三種方式,供公衆、醫療器械生産經營企業和醫療機構等各方查詢使用。國家藥監局網站的醫療器械唯一标識數據庫中,包含UDI 相關政策法規、工作動态、研究應用等相關信息,開放了數據共享查詢和供企業咨詢的幫助台,并公布了系統操作指南、數據申報和數據對接說明、常見問題列表和發碼機構及規則等信息,全方位指導各相關方有序開展UDI 數據申報共享工作。
3.4 發碼機構
UDI 是醫療器械的“國際語言”,發碼機構在UDI 制度建設中十分重要,目前實施UDI 的國家大多都采用多家發碼機構[7-8](表4)。國際上,GS1、HIBCC和ICCBBA 被廣泛使用, 除以上三家發碼機構外,歐盟委員會還認可了德國的IFA。在我國,《規則》未要求認可發碼機構,但提出了基本要求。發碼機構應當為中國境内的法人機構,具備完善的管理制度和運行體系,并将其編碼标準上傳至UDI 數據庫。目前在UDI 數據庫中上傳編碼标準的發碼機構有中國物品編碼中心(GS1 中國)、中關村工信二維碼技術研究院(ZIIOT)和阿裡健康科技(中國)有限公司。

這種多碼并行方式能避免市場壟斷,有效降低轉化成本,使企業可以根據自身需求選擇最适合的編碼類型,并且能夠通過相關國際标準确保各編碼的唯一性[9]。但如果發碼機構過多或者醫療器械注冊人/ 備案人未能嚴格按照發碼機構的标準創建UDI,可能會導緻各方無法正确識别和解析UDI相關信息。
4 UDI 試點和實施
2019 年7 月,國家藥監局、國家衛生健康委聯合印發《醫療器械唯一标識系統試點工作方案》,标志着我國UDI 的試點工作正式啟動[10]。2019 年8 月, 國家藥監局發布《規則》,旨在規範UDI 系統建設,加強醫療器械全生命周期管理,《規則》于2019年10 月1 日起正式施行,基于産品風險程度分步實施。2019 年10 月12 日,國家藥監局發布《關于做好第一批實施醫療器械唯一标識工作有關事項的通<
